Nic tak skutecznie nie niszczy zaufania do szczepień i szczepionek, jak ignorowanie pytań o bezpieczeństwo szczepień, zwłaszcza gdy to sam producent, zamiast odpowiedzieć i rozwiać wątpliwości, udaje przysłowiowego „głupka”, który nie zrozumiał pytania.
Czym jest faza IV badań klinicznych leku lub szczepionki? To po prostu eksperyment przeprowadzany na pacjentach już po dopuszczeniu leku (lub szczepionki) do obrotu. Lekarze zaczynają nowy lek stosować, dzieci są szczepione nową szczepionką i w ten sposób (przynajmniej w teorii) dokonuje się ostateczna weryfikacja, czy testowany produkt medyczny przy rzeczywistym stosowaniu, do jakiego został przeznaczony, jest nadal tak samo bezpieczny, jak wynikało to z testów przeprowadzanych w idealnych warunkach laboratoryjnych, czyli na kilku tysiącach starannie dobranych ochotników.
Infarma pisze o badaniach klinicznych tak:

Jeśli więc szczepionka nie przeszła fazy IV badań klinicznych jej bezpieczeństwa, to znaczy, że nie zweryfikowano, czy naprawdę jest bezpieczna.
Czy chcielibyście wiedzieć, które szczepionki podawane polskim dzieciom pod groźbą kary grzywny zaliczyły fazę IV badań klinicznych?
A kto by nie chciał tego wiedzieć? 🙂
Ale niestety chyba będzie z tym problem…
Pod koniec października wysłałem do Urzędu Rejestracji Produktów Leczniczych oraz do Głównego Inspektora Farmaceutycznego wniosek o informację publiczną:
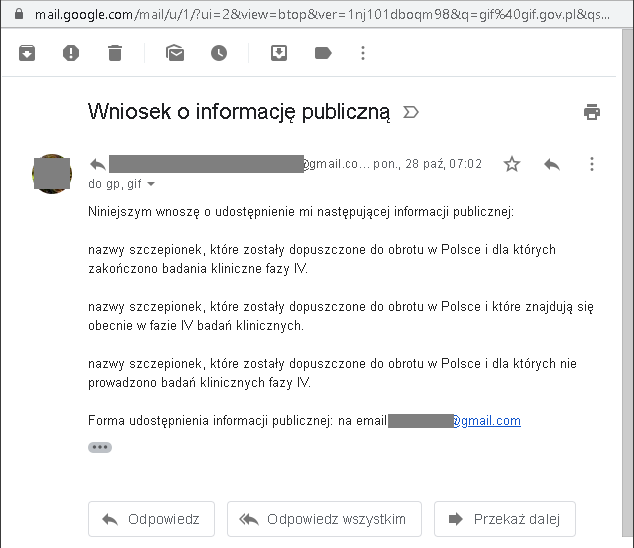
Odpowiedź od GIF nadeszła dosłownie po kilku dniach i polegała na odesłaniu do… URPL. 🙂

Urząd Rejestracji Produktów Leczniczych do dziś nie odpowiedział na ten wniosek, wysłany 28 października, pomimo że w międzyczasie zdążył już odpowiedzieć na inne zapytania, wysłane w listopadzie i w grudniu.
Ciekawe, prawda? 🙂
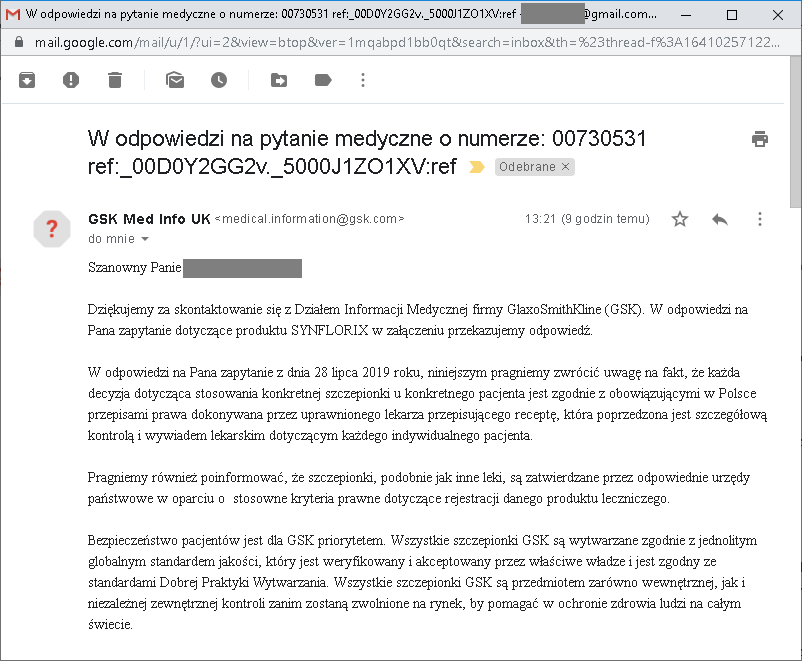
Skoro URPL nie potrafi udostępnić informacji, które ze szczepionek dostępnych w Polsce przeszły fazę IV badań klinicznych, to poprosiłem „wiodących producentów szczepionek” o pomoc i wysłałem do każdego z nich następującego maila:
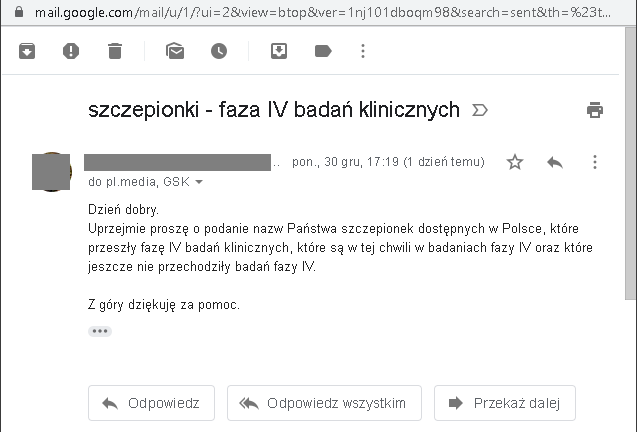
I jest już pierwsza odpowiedź – od GSK, czyli od producenta między innymi słynnego Synflorixa (szczepionki przeciw pneumokokom, PCV10), ale również innych szczepionek, takich jak:
- Bexsero (meningokoki),
- Boostrix (błonica, tężec, krztusiec),
- Boostrix Polio, Cervarix (HPV),
- Fendrix (WZW typ B),
- Engerix B (WZW typu B),
- Fluarix Tetra (grypa),
- Havrix 720 Junior oraz Havrix Adult (WZW typu A),
- Hiberix (Haemophilus influenzae typ b),
- Infanrix DTPa (błonica, tężec, krztusiec),
- Infanrix Hexa (błonica, tężec, krztusiec, WZW typ B, polio, Hib),
- Infanrix IPV (błonica, tężec, krztusiec, polio),
- Infanrix IPV+Hib (błonica, tężec, krztusiec, polio, Hib),
- Menveo (meningokoki),
- Prepandrix (grypa),
- Priorix (odra, świnka, różyczka),
- Priorix Tetra (odra, świnka, różyczka, ospa wietrzna),
- Rabipur (wścieklizna),
- Shingrix (półpasiec),
- Twinrix Adult i Twinrix Junior (WZW typ A + typ B),
- Varilrix (ospa wietrzna).
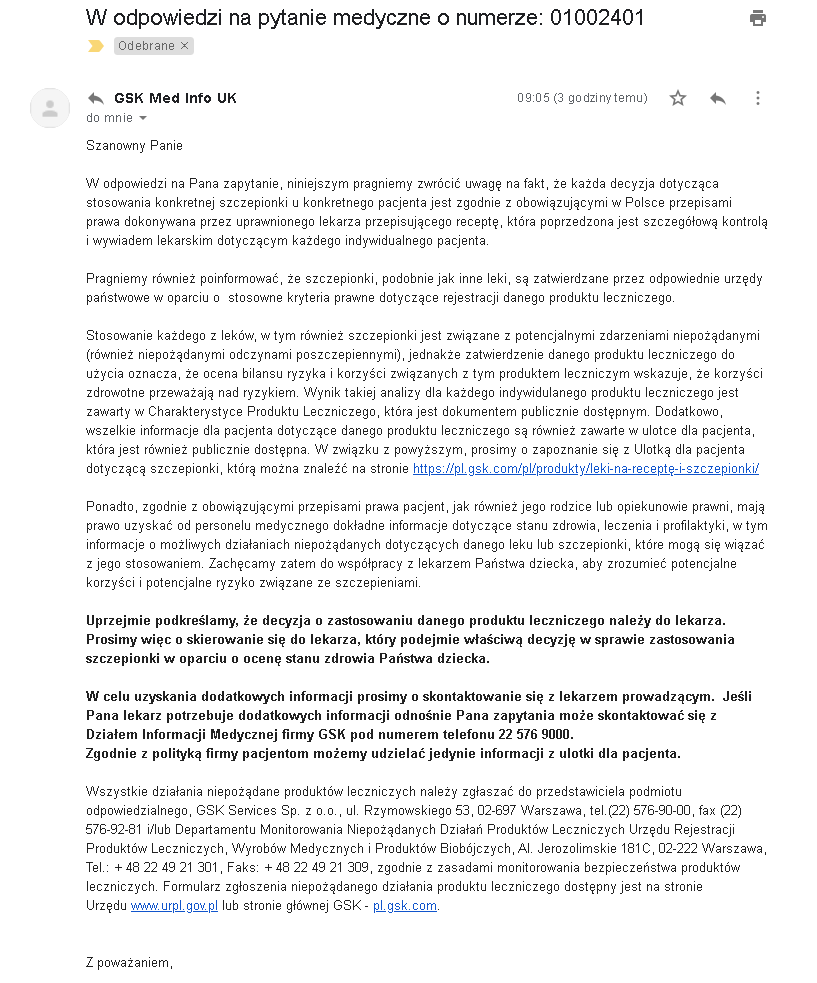
I oto niespodzianka: zamiast uczciwie poinformować, które szczepionki produkowane przez GSK zaliczyły fazę IV, to koncern postanowił udawać idiotę, który nie rozumie prostego pytania.
Odpowiedź od GSK wygląda bowiem tak:
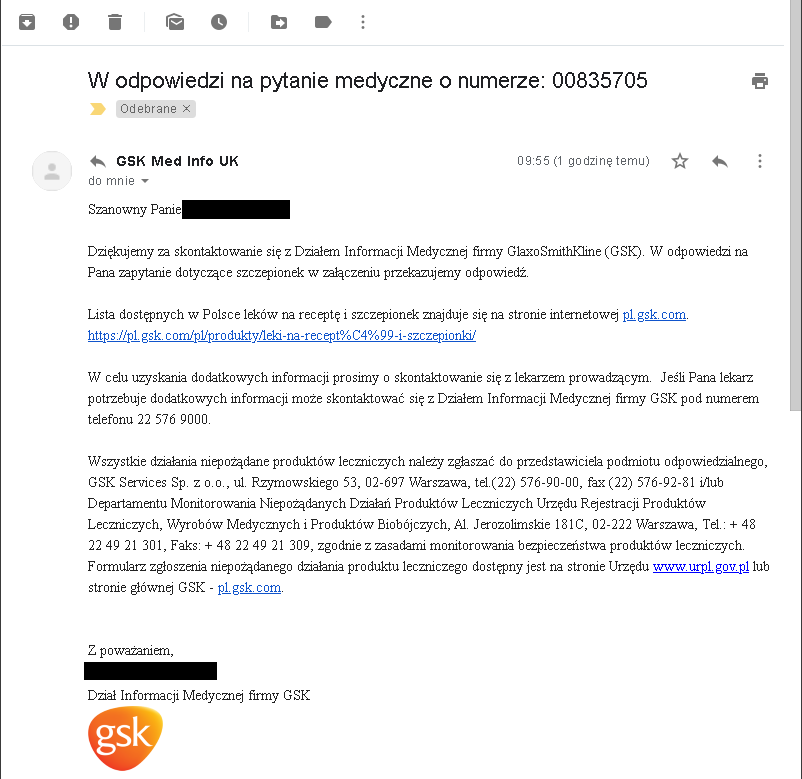
GSK sugeruje, aby o fazę IV badań klinicznych pytać lekarza (serio??!!) i odsyła do listy leków, która znajduje się pod tym adresem: https://pl.gsk.com/pl/produkty/leki-na-recept%C4%99-i-szczepionki/
A gdy wejdziemy na tę stronę i odszukamy sobie na przykład właśnie wyżej wspomniany Synflorix, to otrzymamy coś takiego:
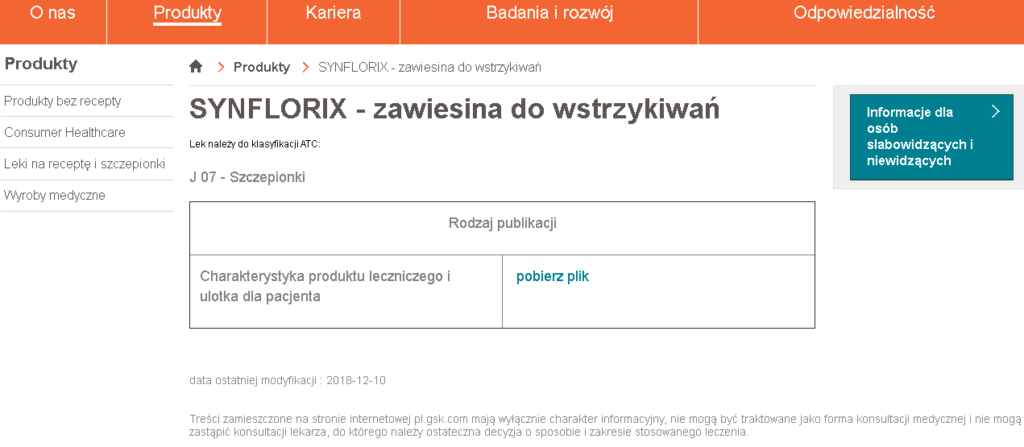
No to zobaczmy w takim razie, czego na temat badań klinicznych tej szczepionki można się dowiedzieć w jej Charakterystyce Produktu Leczniczego:

Co oznacza „faza III/IV”, skoro badanie fazy III przeprowadza się przed zarejestrowaniem szczepionki, a faza IV może się odbywać już po zarejestrowaniu?
Czy Synflorix przeszedł badania fazy IV (a nie fazy „III/IV”), w których sprawdzano, czy ta szczepionka jest rzeczywiście bezpieczna?
Oczywiście takich informacji w ChPL nie znajdziemy. ChPL z założenia nie jest przeglądem [wszystkich] badań klinicznych, którym szczepionka została poddana.
Po co więc producent odsyła do strony, na której co najwyżej można znaleźć ChPL? Albo jeszcze lepiej – po co sugeruje, aby pytać lekarza?
Wyobraźmy sobie minę lekarza, któremu w trakcie badania kwalifikacyjnego rodzic zadaje pytania: „A czy ta szczepionka już przeszła badania kliniczne fazy IV dotyczące bezpieczeństwa jej stosowania? Gdzie i kiedy je prowadzono? Jakie były kryteria wykluczające? Jakie były wyniki? Bo producent kazał mi o to zapytać Pana Doktora…”.
A przecież Synflorix to nie jest jedyna szczepionka GSK, która jest w Polsce podawana dzieciom pod przymusem kary grzywny.
Weźmy na przykład taki Priorix albo Infanrix DTPa. W Charakterystyce szczepionki Infanrix DTPa ani razu nie pojawia się słowo „faz”, „faza” lub „fazy”. Nie ma więc tam żadnej informacji, czy szczepionka przeszła badania kliniczne fazy IV i jakie to były badania – bezpieczeństwa, czy może skuteczności. To samo dotyczy także szczepionek Priorix i Boostrix.
Dalej nie szukam, bo te przykłady już w zupełności wystarczają do udowodnienia, że odesłanie do strony internetowej z listą produktów, na której można sobie co najwyżej odszukać ChPL szczepionki, to nie jest żadna odpowiedź na moje pytanie.
Jak należy więc rozumieć taką zagrywkę GSK?
Czy szczepionki GSK – zwłaszcza te przymusowo podawane polskim dzieciom, nie przechodziły fazy IV badań klinicznych?
Czy polskim dzieciom pod prawnym przymusem podaje się szczepionki, które „są bezpieczne” jedynie na podstawie „testów laboratoryjnych” w fazach od I do III badań klinicznych?
Czy polskim dzieciom podawane są pod prawnym przymusem szczepionki, których bezpieczeństwa nie weryfikowano już po ich wprowadzeniu do obrotu?
Bo jeśli szczepionka nie przeszła badań klinicznych fazy IV, to znaczy, że „jest bezpieczna” jedynie pod warunkiem, że zostanie podana przy zastosowaniu tych samych kryteriów wykluczających, które były brane pod uwagę w badaniach klinicznych faz od I do III oraz że co najwyżej tak samo „bezpieczna”, jak inne szczepionki, które w tych badaniach udawały placebo.
Problem polega na tym, że badanie kwalifikacyjne do szczepienia to przysłowiowe „opukanie i osłuchanie” dziecka oraz zadanie kilku pytań rodzicowi i oczywiście nie ma to nic wspólnego z drobiazgowymi kryteriami wykluczającymi ochotników z „badań bezpieczeństwa” szczepionki w fazach I-III badań klinicznych.
Oto przykładowa lista kryteriów wykluczających przy badaniu skuteczności szczepionki Synflorix:
Kryteria kwalifikujące: zdrowe niemowlęta w wieku 6–16 tygodni.
Kryteria wykluczające: m.in. wcześniejsze szczepienie przeciwko błonicy, tężcowi, krztuścowi, Haemophilus influenzae typu b, wirusowemu zapaleniu wątroby (WZW) typu A i/lub S. pneumoniae; podanie w ciągu poprzedzającego miesiąca szczepionki BCG, szczepionki przeciwko WZW typu B albo doustnej szczepionki przeciwko poliomyelitis; podanie w trakcie badania jakiejkolwiek szczepionki nieuwzględnionej w jego protokole; choroba układu nerwowego lub drgawki w wywiadzie.
Źródło: https://www.mp.pl/szczepienia/przeglad/pneumokoki/112856,skutecznosc-10-walentnej-skoniugowanej-szczepionki-przeciwko-pneumokokom-w-profilaktyce-zakazen-pneumokokowych-u-niemowlat-i-malych-dzieci-badanie-compas
Widzicie, jak badano skuteczność Synflorixa? Skuteczność – a nie bezpieczeństwo. 🙂
Jeśli dziecko było szczepione szczepionką DTP lub jeśli dostało szczepienie przeciw Hib, to nie mogło brać udziału w tym badaniu.
A jakie przeciwwskaznia zapisał producent w ChPL Synflorixa?

Ojej… Ani słowa o chorobach neurologicznych, o drgawkach, o szczepieniu DTP, WZW lub Hib?
Ale jagto?
To po co było tamto „badanie skuteczności”? Co ono właściwie potwierdziło? Że Synflorix jest „skuteczny” jeśli jest podawany dzieciom wcześniej nieszczepionym przeciw żółtaczce, Hib, błonicy, tężcowi i krztuścowi, jeśli nie ma drgawek w wywiadzie oraz jeśli nie ma żadnej choroby układu nerwowego? No i co z tego wynika, skoro w realnym świecie Synflorix będzie seryjnie wstrzykiwany w dzieciaki po szczepieniu DTP, po szczepieniu Hib, pomimo że dziecko miało wcześniej drgawki, lub mimo że ma jakąś chorobę układu nerwowego?
Dlaczego w ChPL producent nie napisał, że przeciwwskazaniem do szczepienia jest „choroba układu nerwowego lub drgawki w wywiadzie”, skoro takie było jedno z „kryteriów wykluczających” w badaniu skuteczności tej szczepionki?
Szczepienia są skuteczne i bezpieczne?
Serio?…
Jeśli chcesz pomóc w utrzymaniu tego bloga, to możesz skorzystać z poniższych metod płatności:
https://zrzutka.pl/2at4jf/wplac
Wsparcie 10zł miesięcznie przez 3 miesiące (kwota 30zł) – kliknij TUTAJ
Wsparcie 10zł miesięcznie przez 6 miesięcy (kwota 60zł) – kliknij TUTAJ
Wsparcie 10zł miesięcznie przez rok (kwota 120zł) – kliknij TUTAJ
Jednorazowa darowizna na kwotę 10zł: kliknij TUTAJ
![]()

![]()

![]() Teresa Dobrzańska-Pielichowska
Teresa Dobrzańska-Pielichowska![]() Małgorzata Mitura-Lesiuk
Małgorzata Mitura-Lesiuk![]() Marcin Smykowski
Marcin Smykowski
![]()
![]()